変動光に立ち向かう光合成の司令塔――シトクロムb6/f複合体の減少が変動光に対する防御の鍵になる――
発表のポイント
◆野外の植物は、陽射しが雲で遮られたり木の葉が風で揺れたりすることで、光の強さが常に変動する環境にさらされています。このような環境は植物の光合成装置に負荷をかけ、特に「光化学系Ⅰ」にダメージを与えることが知られています。
◆光合成の制御において中心的な役割を果たす「シトクロムb6/f複合体」の量を減少させると、光合成の能力は減少するものの、一方で、変動する光から光化学系Ⅰを守る安定性が高まることがわかりました。
◆ この成果は、自然環境で育つ作物が強い陽射しや影といった変動光に負けずに育つ「レジリエンス」注1を高めるための技術開発に貢献することが期待されます。
シトクロムb6/f複合体の減少が野外の光環境で植物の安定した成長を実現する(イメージ図)
概要
東京大学大学院農学生命科学研究科の兒玉大昌大学院生、谷川慶一郎大学院生と矢守航准教授らの研究グループ、自然科学研究機構アストロバイオロジーセンターの河野優特任研究員、国立中興大学の寺島一郎教授は、光合成の重要な役割を担うシトクロムb6/f複合体注2が、「光合成の効率」と「光化学系Ⅰの安定性」とのトレードオフ(両立できない)関係を制御していることを明らかにしました (図1)。
シトクロムb6/f複合体は、光合成における電子の流れを調整する「司令塔」のような存在です(図2)。これまでに、この複合体の量が減ると最大光合成速度が低下することは知られていましたが、それが光変動への応答に与える具体的な影響については解明されていませんでした。今回、研究グループはシトクロムb6/f複合体の量を段階的に減らしたタバコを作成し、その影響を詳細に解析しました。
その結果、野生型(WT)植物では強い光と弱い光が繰り返される変動光環境で光化学系Ⅰがダメージを受けたのに対し、シトクロムb6/f複合体を減らした植物では光合成能力そのものは低下する一方で光化学系Ⅰがダメージをほとんど受けないことが分かりました。これは、シトクロムb6/f複合体の減少が電子の流れを制限する「ブレーキ」としてはたらき、化学系Ⅰに過剰な電子が流れ込むのを防ぐことで実現されます。
この成果は、変動光にさらされる屋外環境での作物栽培において、光合成装置の損傷を防ぎ、作物の安定した生育を実現する新しい戦略の可能性を示しています(図1)。
発表内容
野外に生育する植物は、風で葉が揺れたり雲が流れたりすることで、照射される光の強さが絶えず変化する環境にさらされています。このような「変動光」は光合成装置に負担をかけ、特に光化学系Ⅰにダメージを与えることが知られています(図1, 2)。光化学系Ⅰが傷つくと光合成全体の効率が低下し、植物の成長に悪影響を及ぼすため、このダメージを避ける仕組みを理解することは、作物を健全に育てるうえで重要です。
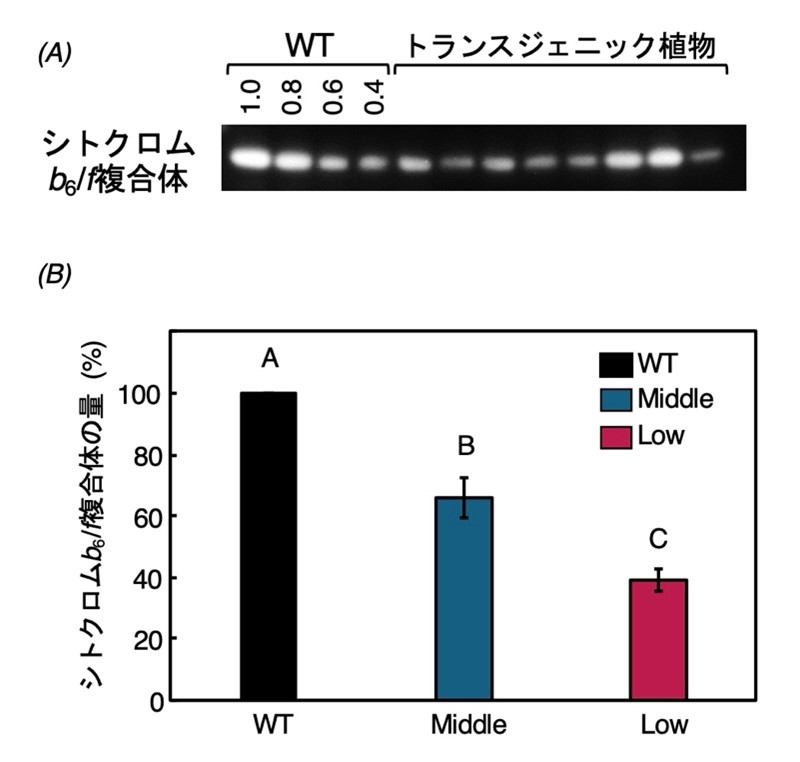
本研究では、光合成の電子伝達における「司令塔」であるシトクロムb6/f複合体(図1, 2)に着目しました。これまで、この複合体の減少が光合成速度を減少させることは知られていましたが、変動光下で光化学系Ⅰの安定性に与える具体的な影響は不明でした。そこで、本研究では、シトクロムb6/f複合体の量が様々に減少したタバコを作成し(図3A)、その含有量に応じて“Middle“グループと”Low“グループに分類しました(図3B)。
◾️シトクロムb6/f複合体の減少は光合成能力の低下につながる
光合成に必要なエネルギーを生み出す「プロトン駆動力(pmf)注3」を調べたところ、シトクロムb6/f複合体の量が減少するほど、pmf全体が小さくなっていました(図4A)。また、シトクロムb6/f複合体の量が大きく減少した“Low”グループにおいて、光化学系Ⅱの活性(図4B)と光化学系Ⅰの活性(図4C)が共に低下していました。
これらの結果から、シトクロムb6/f複合体の大幅な減少は光合成能力の低下を招くことが示され、光合成制御において重要な役割を担っていることが示されました。
◾️シトクロムb6/f複合体の大幅な減少は変動光下で光化学系Ⅰを保護する
続いて、シトクロムb6/f複合体の大幅な減少が変動光下での光合成に与える影響を調べるため、10分間の強光と15分間の弱光を繰り返す変動光条件を与え、野生型(WT)と“Low”グループとの間で光合成パラメータを比較しました(図5)。その結果、図4と同様、変動光中の強光、弱光どちらに対しても光化学系Ⅱの活性(図5A)と光化学系Ⅰの活性(図5B)は低下していました。一方で、光化学系Ⅰの酸化状態を示す指標であるY(ND)がLowグループで顕著に高く(図5C)、変動光下で光化学系Ⅰが常に酸化された状態に維持されたことがわかりました。
また、変動光を照射した後の光合成装置のダメージを調べたところ、WTでは光化学系Ⅰが大きなダメージを受けるのに対し、“Low”グループではほとんどダメージを受けませんでした(図6)。
これらの結果は、シトクロムb6/f複合体の大幅な減少によって光化学系Ⅰへの過剰な電子流入を防ぎ、常に酸化された状態に維持することで、変動光中の強い光から光化学系Ⅰを保護していることを示しています。
◾️作物栽培への応用可能性
本研究の結果、「光合成能力」と「光化学系Ⅰの保護」はトレードオフの関係にあり、そのバランスをシトクロムb6/f複合体が制御していることがわかりました。野外における農業現場では、木陰や雲の切れ間などによって強光と弱光が繰り返される環境が頻繁に発生します。今回の成果は、そのような環境下で利用のバランスを最適化し、作物が受ける光合成装置の損傷を軽減しつつ、安定して高い生産性を維持する新しい技術開発に貢献することが期待されます。
図1:シトクロムb6/f複合体の減少が野外の光環境で植物の安定した成長を実現する(イメージ図)
図2:光合成の電子伝達反応模式図
光合成の電子伝達反応は葉緑体のチラコイド膜中で行われ、生成したNADPHとATPは二酸化炭素の固定に用いられます。電子伝達反応では、まず光化学系Ⅱで水の分解によって生じた電子がシトクロムb6/f複合体を介して光化学系Ⅰへ受け渡され, 最終的に二酸化炭素の固定に必要なNADPHの合成に利用されます。また、この電子伝達に伴って水素イオンがチラコイド膜の内腔側に移動し、その濃度差を利用してATP合成が行われます。
図3:トランスジェニック植物におけるシトクロムb6/f複合体の量
(A)野生型(WT)植物と比較してシトクロムb6/f複合体の量が減少したトランスジェニック植物を作出しました。また、(B)Cytochrome b6/f複合体の量によってトランスジェニック植物を”Middle”グループ(野生型の43.6〜76.3%)と”Low”グループ(野生型の18.5〜42.2%)に分けて光合成特性を解析しました。データは平均値±標準誤差(n=3〜5)で、異なるアルファベットはTukey-HSD検定により、P<0.05の水準で有意差が認められたことを示しています。
図4:野生型(WT)植物とトランスジェニック植物における光合成能力の比較
Dual-PAM-100を用いて、光の強さに対する光合成活性を測定しました。(A)シトクロムb6/f複合体量の減少量にしたがってプロトン駆動力(pmf)が低下しました。また、”Low”グループにおいて(B)光化学系Ⅱの活性(Y(Ⅱ))注4、(C)光化学系Ⅰの活性(Y(Ⅰ))注5がいずれも低下しました。データは平均値±標準誤差(n=3〜5)です。
図5:野生型(WT)植物と“Low”グループ植物における変動光に対する光合成パラメータの比較
Dual-PAM-100を用いて、変動光に対する光合成活性を測定しました。シトクロムb6/f複合体量が大きく減少した“Low”グループにおいて(A)光化学系Ⅱの活性(Y(Ⅱ))、(B)光化学系Ⅰの活性(Y(Ⅰ))が強光、弱光ともに低下しました。また、(C)光化学系Ⅰがどの程度酸化されているかを示す指標Y(ND)注5が強光、弱光ともに常に高く維持されました。LLは弱光、HLは強光を照射したことを示しています。データは平均値±標準誤差(n=3〜5)です。
図6:野生型(WT)植物と“Low”グループ植物における変動光による光化学系Ⅰのダメージ
Dual-PAM-100を用いて、弱光(30μmol m-2 s-1)と強光(2000、3000、20000μmol m-2 s-1のいずれか)の繰り返し照射による光化学系Ⅰが受けるダメージの程度を、光照射前後のPm注6の値を比較することで評価しました。その結果、“Low”グループでは変動光による光阻害が見られませんでした。データは平均値±標準誤差(n=3〜5)です。*はt検定によってP<0.05の水準で有意差が認められたことを示しています。
発表者・研究者等情報
東京大学
大学院農学生命科学研究科
兒玉 大昌 修士課程
谷川 慶一郎 博士課程
矢守 航 准教授
大学院理学系研究科
寺島 一郎 東京大学名誉教授(現:国立中興大学(台湾) 教授)
自然科学研究機構アストロバイオロジーセンター
河野 優 特任研究員
論文情報
雑誌名:Physiologia Plantarum
題 名:Drastic Reduction in Cytochrome b6/f Complex Confers Robust PSI Photoprotection under Fluctuating Light at the Expense of Photosynthetic Capacity
著者名:Masaru Kono, Hiromasa Kodama, Keiichiro Tanigawa, Ichiro Terashima, Wataru Yamori
DOI:10.1111/ppl.70483
URL: https://onlinelibrary.wiley.com/doi/10.1111/ppl.70483
研究助成
本研究は、日本学術振興会科研費「基盤研究(C)(課題番号:24K09493)」、「国際共同研究強化(B)(課題番号:18KK0170)」、「基盤研究(B)(課題番号:21H02171)」、「学術変革領域研究(A)(課題番号:24H02277)」、「基盤研究(B)(課題番号:22H02640)」の支援により実施されました。
用語解説
1)レジリエンス
ストレスに対する回復力(復元力)、抵抗力を指す。本プレスリリースでは、変動光というストレス環境に対してダメージを受けにくく安定状態を維持することを指す。
2)シトクロムb6/f複合体
光合成の電子伝達反応において光化学系Ⅱと光化学系Ⅰの間の電子伝達を担うタンパク質複合体。
3)pmf
葉緑体のチラコイド膜を隔てた水素イオンの電気化学ポテンシャルの差のこと。ATPを合成する原動力となる。チラコイド膜に存在するカロテノイドなどの光合成色素の吸収スペクトル(ある光の波長をどの程度吸収するか)が膜電位の変化に伴ってそのピークが移動する現象(エレクトロクロミックシフト、ECS)を利用して、その変化を測定するECS解析という手法によって定量することができる。
4)Y(Ⅱ)
光化学系Ⅱの実効量子収率で光化学系Ⅱ活性の指標として用いられる。光化学系Ⅱのクロロフィルから発せられる蛍光を測定するPAMクロロフィル蛍光法を用いることで、定量することができる。
5)Y(Ⅰ)、Y(ND)
Y(Ⅰ):光化学系Ⅰの実効量子収率、Y(ND):光化学系Ⅰのドナー側の制限。前述の光化学系Ⅰにおける光の吸収変化を測定することで定量される。Y(Ⅰ)は光化学系Ⅰ活性の指標、Y(ND)は光化学系Ⅰがどの程度酸化されているかを示す指標として用いられる。
6)Pm
分光学的な光化学系Ⅰの最大量の指標。光化学系Ⅰの反応中心クロロフィルは酸化還元状態に伴って、吸収スペクトルが変化する。この吸収変化を測定することで定量することができる。
問合せ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科附属生態調和農学機構
准教授 矢守 航(やもり わたる)
TEL:070-6442-9511 E-mail:yamori[at]g.ecc.u-tokyo.ac.jp
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
TEL:03-5841-8179, 5484 FAX:03-5841-5028 E-mail:koho.a[at]gs.mail.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。