植物ウイルスに対する劣性抵抗性の中枢因子を解明 ――ゲノム編集を利用したウイルス抵抗性作物の開発につながる成果――
- 発表者
- 東京大学大学院 農学生命科学研究科 生産・環境生物学専攻
西川 雅展(特任研究員)
勝 浩介 (修士課程:研究当時)
鯉沼 宏章(特任研究員)
山次 康幸(教授)
発表のポイント
- 様々な作物において、植物の翻訳に関わる「eIF4Eファミリー」遺伝子が変異するとウイルスが感染できない劣性(潜性)抵抗性植物になることが知られています。
- 植物にeIF4Eファミリー遺伝子は3つ存在し、それぞれ異なるウイルスに対する劣性抵抗性に関与しますが、3つのeIF4Eファミリー遺伝子がいずれも当研究室で発見した別のウイルス劣性抵抗性遺伝子EXA1と結合して働くことによりウイルスの感染を助けていることを明らかにしました。
- ゲノム編集技術を利用してeIF4EファミリーとEXA1の結合性を改変することで、ウイルス抵抗性作物の開発につながると期待されます。

ウイルスに感染した植物(左)とウイルスが利用する植物の遺伝子に変異が入り抵抗性をもつ植物(右)
発表内容

図1:ポテックスウイルス感染植物の病徴
(拡大画像↗)
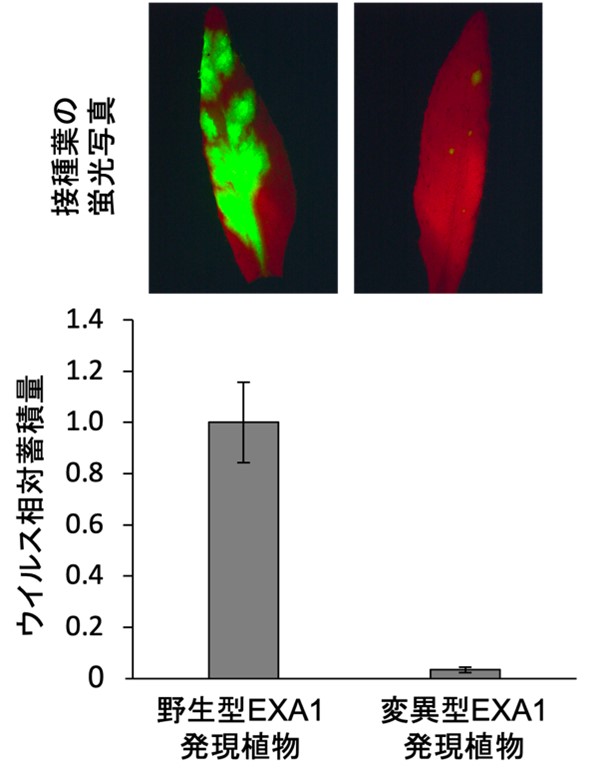
図2:ポテックスウイルスの感染におけるEXA1のeIF4E結合モチーフの必要性
GFPを組み込んだ光るウイルスをそれぞれの植物に接種して、ウイルスに対する抵抗性を調べた。野生型EXA1を持つシロイヌナズナの葉 (上段・左) ではウイルスが増殖してGFP蛍光が明瞭に観察される一方、eIF4E結合モチーフに変異を導入したEXA1を持つシロイヌナズナの葉 (上段・右) ではウイルスの増殖が抑制される。接種葉におけるウイルスRNA蓄積量は、野生型EXA1発現植物に比べて、変異型EXA1発現植物で顕著に減少する (下段)。
(拡大画像↗)
〈研究の概要〉
東京大学大学院農学生命科学研究科の西川雅展特任研究員、山次康幸教授らの研究グループは、機能未知のウイルス劣性抵抗性遺伝子EXA1について解析し、様々なウイルスに対する劣性抵抗性遺伝子として知られる3つのeIF4Eファミリー遺伝子とそれぞれ結合することにより劣性抵抗性の中枢因子として働くことを明らかにしました。
〈研究の背景〉
世界の作物生産において、植物ウイルス病による損失は年間300億ドルにものぼると推定され、温暖化や貿易のグローバル化などの影響によりその損失は世界的に増加する傾向にあります。ウイルス病に対して有効な化学農薬は存在しないため、作物をウイルス抵抗性を持つ近縁種と交配することで生み出された抵抗性品種の利用が最も効果的なウイルス防除手段です。しかし、抵抗性品種の開発には膨大な労力と時間が必要となるため、増加し続ける植物ウイルスの被害に対して抵抗性品種の開発が追いついていません。
ウイルスが植物に感染する際には、植物が持つ様々な遺伝子 (注1) を利用して、自身の増殖や植物体内での移動を行っています。したがって、それらの遺伝子に変異が生じると植物にウイルスは感染できなくなります。このようにして生じるウイルス抵抗性は「劣性(潜性)抵抗性」 (注2) と呼ばれています。劣性抵抗性遺伝子として最も有名なのがeIF4Eファミリー遺伝子であり、植物ではeIF4E、eIFiso4E、nCBPとよばれる3つの遺伝子が存在しますが、それぞれが異なる植物ウイルスに対する劣性抵抗性遺伝子として働くことが知られています。ウイルスの感染に必須な植物遺伝子を特定してその機能を明らかにし、ウイルスが利用できないように変異を導入することで、劣性抵抗性を利用した抵抗性品種を開発できれば、効果的なウイルス防除が可能になると考えられます。
主要な植物ウイルスグループの一つに、ポテックスウイルス (注3) があります。ポテックスウイルスには約50種の植物ウイルスが含まれ、その中には世界的にトマト生産に甚大な被害を与え我が国への侵入が警戒されているpepino mosaic virus (PepMV) や、ユリ等の花き類に発生し商品価値を低下させるplantago asiatica mosaic virus (PlAMV) 等の重要なウイルスが含まれています (図1)。ポテックスウイルスによる被害は近年急速に増加していますが、抵抗性品種は未だに実用化されていないため、早急な対策が求められています。
これに対し当研究室では、シロイヌナズナ変異体約10000個体以上の中から、ウイルスが全く感染できず劣性抵抗性を示す変異体を見出し、原因遺伝子を特定してEssential for poteXvirus Accumulation 1 (EXA1) と命名しました。EXA1は植物に広く保存された遺伝子で、PlAMVのほか複数のポテックスウイルスの感染に重要です。EXA1はポテックスウイルスが植物に感染するために不可欠な機能を持つと考えられますが、具体的な分子機能はわかっていませんでした。
〈研究内容〉
EXA1の配列を解析したところ、劣性抵抗性遺伝子として有名なeIF4Eファミリー (注4) との結合に関わるアミノ酸配列 (eIF4E結合モチーフ) が存在していることがわかりました。そこで、EXA1による劣性抵抗性とeIF4Eファミリーによる劣性抵抗性の関係を調べることにしました。EXA1がeIF4Eファミリーと結合するかどうかを、共免疫沈降法により検証したところ、EXA1は3つのeIF4Eファミリーすべてと実際に結合し、これらの結合にはEXA1のeIF4E結合モチーフが必要であることがわかりました。
そこで次に、EXA1-eIF4Eファミリー間の結合がポテックスウイルスの感染に必要かどうかを検証しました。EXA1-eIF4Eファミリー間の結合を抑制するために、eIF4E結合モチーフに変異導入したEXA1遺伝子を持つシロイヌナズナ系統 (変異型EXA1発現植物) を作出し、ポテックスウイルスに属するPlAMVを接種しました。その結果、野生型のEXA1を持つシロイヌナズナ (野生型EXA1発現植物) にはPlAMVが感染する一方で、変異型EXA1発現植物ではPlAMVの感染が抑制されることが分かりました (図2)。したがって、EXA1-eIF4Eファミリー間の結合はPlAMVの感染に必要であることが明らかになり、PlAMVの感染においてEXA1はeIF4Eファミリーと協調して働いていることが示唆されました。このことは、eIF4Eファミリーが変異したシロイヌナズナ変異体にPlAMVを接種した際に、PlAMVの蓄積が抑制されたことからも支持されました。
〈今後の展望・社会的意義〉
本研究により、EXA1が3つのeIF4Eファミリーといずれも結合することにより協調的に働いてウイルスの感染を助けていることを明らかにし、EXA1が劣性抵抗性の中枢因子として働くことを示唆しました。eIF4Eファミリーは、植物のメッセンジャーRNAやウイルスRNAに存在するキャップ構造 (注5) に結合する性質を持ちます。したがって、EXA1とeIF4EファミリーはPlAMVのRNAに存在するキャップ構造に結合して機能すると想定されます。今後EXA1とeIF4EファミリーによるウイルスRNA制御機構を解析することで、PlAMVの感染メカニズムが詳細に明らかになると期待されます。
ウイルス病の防除においては、ウイルスが利用する植物遺伝子を特定し、それらが変異した劣性抵抗性植物を利用した抵抗性品種の開発に応用することが効果的なアプローチの一つです。しかし、特定の遺伝子を破壊すると植物の生育に悪影響が生じる場合があり、実際にEXA1を欠損したシロイヌナズナは野生型植物に比べて生育が悪くなります。本研究では、eIF4E結合モチーフに変異を導入したEXA1を持つ植物は野生型植物と遜色なく生育することを見出しました。近年、ゲノム編集技術 (注6) により、作物の遺伝子配列を自在に改変できるようになりつつあります。EXA1とeIF4Eファミリーは植物に広く保存されているため、作物の持つEXA1にeIF4Eファミリーとの結合を損なうような変異を導入することで、様々な作物において植物の生育への影響を抑えつつ、国内外で問題となっているポテックスウイルスに対する抵抗性品種を開発できると期待されます。
〈関連のプレスリリース〉
・ノックアウトするとウイルス抵抗性になる植物タンパク質遺伝子を発見 ~ 精密ゲノム編集を利用したウイルス抵抗性作物の開発につながる成果 ~ 【2016年10月12日】
https://www.a.u-tokyo.ac.jp/topics/2016/20161012-1.html
・ウイルスは植物の翻訳装置をハイジャックすることを発見 【2017年1月11日】
https://www.a.u-tokyo.ac.jp/topics/2017/20170111-3.html
発表雑誌
- 雑誌名
- Journal of Virology
- 論文タイトル
- Interaction of EXA1 and eIF4E family members facilitates potexvirus infection in Arabidopsis thaliana
- 著者
- Masanobu Nishikawa, Kosuke Katsu, Hiroaki Koinuma, Masayoshi Hashimoto, Yutaro Neriya, Juri Matsuyama, Toya Yamamoto, Masato Suzuki, Oki Matsumoto, Hidenori Matsui, Hirofumi Nakagami, Kensaku Maejima, Shigetou Namba, Yasuyuki Yamaji
- DOI番号
- 10.1128/jvi.00221-23
- 論文URL
- https://journals.asm.org/doi/10.1128/jvi.00221-23
研究助成
本研究は、日本学術振興会科学研究費補助金 (課題番号:17H03770、20J23036、21H04722、22K19168) の支援を受けて行われました。
用語解説
- 注1 遺伝子とタンパク質
生物の遺伝情報は、4種類のデオキシリボ核酸(DNA)からなる配列(塩基配列と呼ばれます)として記録されています。DNAに記録された遺伝情報は、タンパク質として合成されることで初めて機能します。最初に「転写」という反応によりDNAから、メッセンジャーRNAと呼ばれるリボ核酸(RNA)が合成されます。さらにメッセンジャーRNAから、「翻訳」と呼ばれる反応により、さまざまな生理活性をもつタンパク質が合成されます。上記の過程によりタンパク質合成の設計図となるDNA配列を遺伝子と呼びます。 - 注2 劣性抵抗性
ウイルス感染に特に重要な植物遺伝子が失われると、ウイルスは感染できなくなり、植物にはウイルス抵抗性が付与されます。このような抵抗性は遺伝学的に劣性 (潜性) 遺伝するため、「劣性抵抗性」と呼ばれています。劣性抵抗性は他の抵抗性に比べて効果や持続性が高いことから、イネ、オオムギ、トマト、レタス、ピーマン、メロン等の作物で抵抗性品種が利用されています。 - 注3 ポテックスウイルス
ひも状粒子をもつ1本鎖RNAをゲノムとする植物ウイルスのグループで、分類学的にはポテックスウイルス属と呼ばれます。ポテックスウイルスには約50種のウイルスが含まれ、ウイルス粒子は幅13 nm(ナノメートル)、長さ470-580 nmからなるひも状粒子です。代表的なウイルスとしては、世界中でジャガイモに感染し、他属のウイルスと重複感染して激しい被害を引き起こすpotato virus Xや、約20年前にヨーロッパで発見され急速に北南米などに感染範囲を拡大しトマト生産に甚大な被害を与えているPepMV、ランの主要ウイルスであるcymbidium mosaic virus、世界のユリ生産地で大きな被害を与えるPlAMVなどが含まれます。 - 注4 eIF4Eファミリー
翻訳と呼ばれる反応により、メッセンジャーRNAの遺伝子配列をもとにタンパク質が合成されますが、翻訳反応の開始に関わるタンパク質を翻訳開始因子(eukaryotic translation initiation factor, eIF)と呼びます。翻訳開始因子には多数のタンパク質が含まれますが、そのうちeIF4Eと呼ばれるタンパク質が様々な植物ウイルスに対する劣性抵抗性の決定因子として報告されています。eIF4Eは遺伝子ファミリーを構成し、植物にはeIF4E、eIFiso4E、nCBPの3つが存在します。 - 注5 キャップ構造
真核生物のメッセンジャーRNAが5′末端に持つ構造です。キャップ構造にはeIF4Eファミリーが結合し、さらにeIF4Eファミリーに他の翻訳開始因子が結合することで、メッセンジャーRNAの翻訳反応が開始されます。 - 注6 ゲノム編集技術
ある特定の塩基配列に特異的なDNA分解酵素を用いることにより、標的とする遺伝子を自在に操作することをゲノム編集と呼びます。DNA分解酵素には、ジンクフィンガーヌクレアーゼ、TALEN、CRISPR/Cas9等があります。DNA分解酵素がターゲットとする塩基配列は、自由に設計でき、従来の遺伝子組換え技術に比べて、格段に遺伝子操作の自由度が高い点に特徴があります。植物では、ゲノム編集を行う際に必要なDNA分解酵素などの外来遺伝子を遺伝子組換えにより植物ゲノムに導入する必要がありますが、目的遺伝子を改変した後に、非組換え植物との交配により、次世代では外来遺伝子をもたない個体を得ることが可能です。このことから、遺伝子組換え技術を用いるものの組換え遺伝子を残すことなく標的の遺伝子のみを改変することができます。
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻 植物病理学研究室
教授 山次 康幸 (やまじ やすゆき)
Tel:03-5841-5092
Fax:03-5841-5090
E-mail:ayyamaji<アット>g.ecc.u-tokyo.ac.jp
研究室URL:http://park.itc.u-tokyo.ac.jp/ae-b/planpath/
<アット>を@に変えてください。

