イヌの骨肉腫に対する新規治療薬候補を発見!! ――HER2を標的とする抗体薬物複合体のイヌの癌に対する効果が明らかに――
発表のポイント
- イヌ骨肉腫に対して、HER2を標的とする抗体薬に抗癌剤を結合させたトラスツズマブ-エムタンシン(T-DM1、製品名:カドサイラ)が抗腫瘍効果を示すことを発見しました。
- イヌ骨肉腫細胞株に対するT-DMのアポトーシス誘導作用を明らかにしました。
- 骨肉腫に罹患したイヌに対してT-DM1が新たな治療薬となることが期待されます。
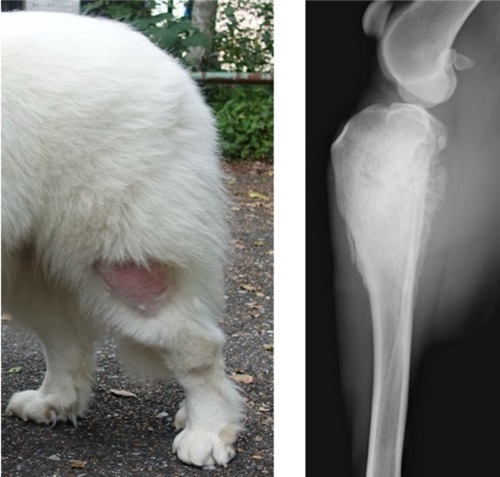
骨肉腫に罹患したイヌの写真とレントゲン写真
研究内容
北里大学獣医学部獣医学科の酒居幸生講師、東京大学大学院農学生命科学研究科の中川貴之准教授、加藤大貴特任講師らの研究グループは、これまでの研究において受容体型チロシンキナーゼ(注1)の一つであるHER2がイヌの様々な悪性腫瘍(乳癌や尿路上皮癌、前立腺癌、肛門嚢腺癌、甲状腺癌など)で高発現していることを発見し、新たな治療標的となる可能性を報告してきました。一方で、イヌと同様にヒトでも、乳癌をはじめ、様々な悪性腫瘍でHER2の高発現が報告されています。さらにはヒトHER2に対する抗体薬が開発され、その抗腫瘍効果が腫瘍細胞株や担癌モデルマウス、実際のヒト癌患者で証明されています。一方、イヌの悪性腫瘍に対する上述の抗体薬の効果はよく分かっていませんでした。
今回、研究グループは医薬品として開発された抗HER2抗体(トラスツズマブ)とこれに抗癌剤を結合させた抗体薬物複合体(トラスツズマブ-エムタンシン [T-DM1]、製品名:カドサイラ、注2)に着目し、まずイヌ骨肉腫細胞株に対する効果を検討しました。その結果、特にT-DM1で濃度依存性に細胞株の生存率が顕著に低下しました(図1)。
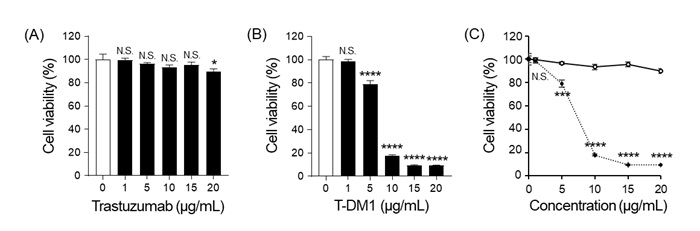
図1:トラスツズマブとT-DM1はイヌ骨肉腫細胞株の生存率を低下させ、特にT-DM1でより大きな効果が認められた
A)高濃度のトラスツズマブにより細胞生存率が僅かに低下した。
B)T-DM1の濃度依存性に細胞生存率が顕著に低下した。
C)T-DM1(点線)はトラスツズマブ(実線)に比べて細胞生存率を有意に低下させた。
N.S.: P >0.05 、*: P <0.05、***: P <0.001、****: P <0.0001
そこで、T-DM1の作用メカニズムを調べるために、細胞周期解析およびアネキシンアッセイという詳細な検証を行ったところ、T-DM1により腫瘍細胞にアポトーシス(注3)が誘導されることが分かりました(図2)。続いて、担癌モデルマウスに対する各抗体薬の効果を検討しました。イヌ骨肉腫細胞株を皮下移植した免疫不全マウスに各抗体薬を投与したところ、T-DM1により腫瘤体積の増大が抑制されました(図3)。つまり、イヌ骨肉腫の細胞株および担癌モデルマウスに対してT-DM1が抗腫瘍効果を示し、その作用メカニズムとしてアポトーシス誘導が重要であることが明らかになりました。
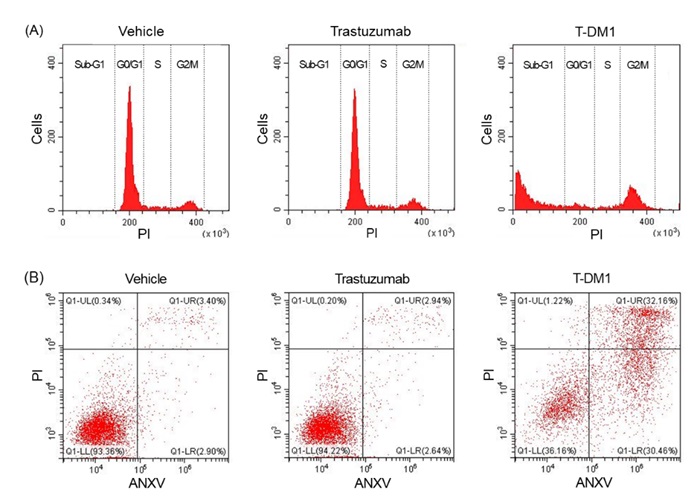
図2:T-DM1はイヌ骨肉腫細胞株に対してアポトーシスを誘導した
A)細胞周期解析において、T-DM1は溶媒やトラスツズマブに比べてSub-G1期の割合を増加させている。つまりT-DM1により、細胞のDNAの断片化が生じており、細胞死(アポトーシス)が誘導されていることがわかった。
B)アネキシンアッセイにおいて、T-DM1は溶媒やトラスツズマブに比べて早期アポトーシス(ANX陽性PI陰性細胞:表右下)および後期アポトーシス(ANX陽性PI陽性細胞:表右上)の割合を増加させた。
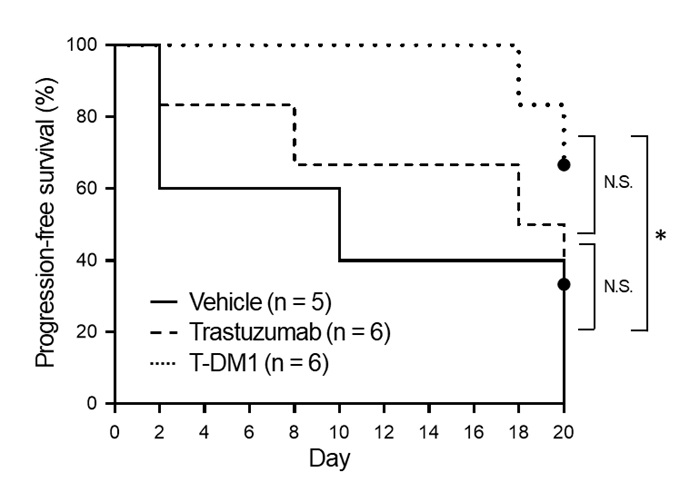
図3:T-DM1はイヌ骨肉腫の担癌モデルマウスに対して抗腫瘍効果を示した
T-DM1投与群では溶媒投与群に比べて規定腫瘤体積までの生存期間が有意に延長した。
N.S.: P >0.05 、*: P <0.05
イヌの骨肉腫に対する治療の第一選択は外科手術ですが、術後に腫瘍の遠隔転移が高い確率で認められることから、術後化学療法も重要となります。しかし、従来の化学療法はある程度の治療効果を示すものの、症例の生存期間中央値が1年以下です。本研究では、骨肉腫に罹患したイヌに対する新規治療薬候補としてT-DM1を見出すことに成功しました。したがって、今後の研究においてイヌに対するT-DM1の至適用量を検討した後、臨床試験を進めることで、イヌ骨肉腫に対する新たな治療法を提唱できる可能性があります。また、研究グループはこれまでに、イヌ尿路上皮癌の細胞株および担癌モデルマウスに対するT-DM1の抗腫瘍効果を明らかにしているため、本研究により癌種を超えたT-DM1の有効性が示唆されました。HER2の高発現はイヌの様々な悪性腫瘍で報告されていることから、T-DM1の応用範囲の拡大も期待されます。
〈関連のプレスリリース〉
「犬の尿路上皮癌に対する新規治療薬候補を発見!!―HER2を標的とする抗体薬の効果が明らかに―」(2024/3/19)
https://www.a.u-tokyo.ac.jp/topics/topics_20240321-1.html
「犬の肺癌の新たな治療標的を発見」(2020/04/10)
https://www.a.u-tokyo.ac.jp/topics/topics_20200403-1.html
「犬の希少がんの治療標的を発見」(2019/05/29)
https://www.a.u-tokyo.ac.jp/topics/topics_20190529-1.html
発表者
北里大学 獣医学部獣医学科
酒居 幸生(講師)
亀島 聡(准教授)
東京大学 大学院農学生命科学研究科
加藤 大貴(特任講師)
本阿彌 宗紀(特任助教)
高橋 洋介(特任研究員)
池田 凡子(特任研究員)
青木 督(博士課程)
井口 貴瑛(博士課程)
秦 詩雨(博士課程)
安藤 未来(博士課程)
中川 貴之(准教授)
大阪府立大学 生命環境科学域
吉中 潤華(学部学生:研究当時)
大阪公立大学 大学院獣医学研究科
島村 俊介(准教授)
論文情報
- 雑誌
- The Journal of Veterinary Medical Science
- 題名
- Effects of trastuzumab emtansine on canine osteosarcoma cells
- 著者
- Kosei Sakai*, Daiki Kato*, Junka Yoshinaka, Muneki Honnami, Yosuke Takahashi, Namiko Ikeda, Susumu Aoki, Takaaki Iguchi, Qin Shiyu, Miki Ando, Satoshi Kameshima, Shunsuke Shimamura, Takayuki Nakagawa (* 責任著者)
- DOI
- https://doi.org/10.1292/jvms.24-0201
- URL
- https://www.jstage.jst.go.jp/browse/jvms/advpub/0/_contents/-char/en
研究助成
本研究は、独立行政法人 日本学術振興会 科研費(課題番号:JP24H00539、JP23K05532、JP23H00356、JP20H03141、JP20KK0153)の支援により実施されました。
用語解説
- 注1)受容体型チロシンキナーゼ
細胞膜上に存在する糖タンパクで、様々な悪性腫瘍の進展に関連することが報告されている。 - 注2)T-DM1 (製品名: カドサイラ)
トラスツズマブに微小管重合阻害剤であるDM1(メイタンシン誘導体)を結合させた抗体薬物複合体である。HER2を介して細胞内に取り込まれた際、DM1が細胞傷害活性を示すため、トラスツズマブ単体よりも高い抗腫瘍効果が期待される。 - 注3)アポトーシス
有害な外的刺激より誘発される受動的な細胞死(ネクローシス)と異なり、遺伝子的にプログラムされた能動的な細胞死である。
問い合わせ先
〈研究に関する問合せ〉
北里大学 獣医学部獣医学科 小動物第1内科学研究室
講師 酒居 幸生 (さかい こうせい)
E-mail: sakai.kosei[at]kitasato-u.ac.jp
東京大学 大学院農学生命科学研究科 獣医学専攻 獣医外科学研究室
准教授 中川 貴之(なかがわ たかゆき)
Fax: 03-5841-5420
E-mail: anakaga[at]g.ecc.u-tokyo.ac.jp
〈報道に関する問合せ〉
学校法人北里研究所広報室
〒108-8641 東京都港区白金5-9-1
メール:kohoh[at]kitasato-u.ac.jp
東京大学大学院農学生命科学研究科・農学部
事務部 総務課総務チーム 総務・広報情報担当(広報情報担当)
Tel: 03-5841-8179 Fax: 03-5841-5028
E-mail: koho.a[at]gs.mail.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。
関連教員
中川 貴之

