巧みな官能基変換を用いた天然有機化合物の生合成戦略の解明
1.発表のポイント
- 放線菌が生産する抗腫瘍物質、フラキノシンが、これまで考えられていたキノン型中間体ではなく還元されたヒドロキノン型中間体を経由して生合成されることを明らかにしました。
- 一見必要ないアミノ基を生合成中間体に一時的に導入した後、ジアゾ化(注1)によって、ヒドロキノン型中間体を安定化させるメロテルペノイド(注2)共通の生合成経路を明らかにしました。
- S-アデノシルメチオニン(SAM、注3)依存的にメチル基転移を触媒する酵素にアミノ酸配列が似ている酵素、Fur21が、SAM非依存的に環化反応を触媒する酵素であることを明らかにしました。
2.発表概要
微生物の一種である放線菌の中には、抗腫瘍、抗菌、抗酸化活性などを示すメロテルペノイドと呼ばれる天然化合物を生産するものがいます。対称性の高いテトラヒドロキシナフタレン(THN)から生合成されるメロテルペノイドの多様な生物活性の基となる構造の多様性は、よく似たナフトキノン骨格とテルペノイド骨格が融合したのち、テルペノイド部分が異なる機構によって環化することで生み出されます。
東京大学大学院農学生命科学研究科応用生命工学専攻の共同研究グループは、THN由来のメロテルペノイドの一種であるフラキノシンやナフテルピンの特徴的な構造がどのように生合成されるのかを研究しています。フラキノシンをはじめとしたメロテルペノイドにはアミノ基が存在しませんが、アミノ基を有する8-アミノフラビオリンが共通の生合成の中間体であることをこれまでに明らかにしてきました。しかし、なぜ最終的なメロテルペノイドに存在しないアミノ基をわざわざ導入することで8-アミノフラビオリンを生合成するのか、そしてフラキノシンに特異的な環化反応はどのようにして起こるのかについては未解明でした。今回、同グループではフラキノシンの生合成経路の全容を解明し、8-アミノフラビオリンのアミノ基の重要性を示しました。一見必要なさそうなアミノ基は、メロテルペノイド共通のジアゾ化を経由したヒドロキノン型生合成中間体PHNの生合成に重要な役割を果たすこと、PHNはTHNと比べて対称性が崩れていることで以降の修飾酵素の反応位置を決定づけることができること、最終的にS-アデノシルメチオニン(SAM)を用いるメチル基転移酵素とよく似た酵素Fur21がメチル化ではなく珍しい環化反応を触媒することで、フラキノシンが従来の定説とは異なるヒドロキノン型として生合成されることを明らかにしました。アミノ基を出発点とした巧みな官能基変換の解明は、メロテルペノイドをはじめとした天然化合物の構造多様化戦略の理解に繋がります。
3.発表内容
放線菌が生産するTHN由来のメロテルペノイドとして、Streptomyces sp. KO-3988の生産するフラキノシン(1)をはじめとして、Streptomyces sp. CL190の生産するナフテルピン (2)に加えて、フラノナフトキノン(3)やナピラジオマイシン(4)などが知られています。メロテルペノイドは、よく似た構造のナフトキノン骨格(青色)とテルペノイド骨格(赤色)が融合し、さらにテルペノイド部分が環化することで構造多様性が生み出されているという特徴があります(図 1)。この構造多様性のため、抗腫瘍、抗菌、抗酸化活性などの多様な生物活性を示します。これらメロテルペノイドに共通の生合成中間体として8-アミノフラビオリン(5)が同定され、グルタミン酸由来のアミノ基が導入されることが明らかにされていました。しかし、ナフテルピン等いずれのメロテルペノイドにも8位のアミノ基が存在せず、アミノ基は水素原子に置換されます。この普遍的なアミノ基除去反応はこれまでに知られている機構とは大きく異なるため、反応機構や生理的意義を含め興味深い研究対象でありました(図1)。一方でTHN由来のメロテルペノイドの構造多様性に重要な環化反応についても知見が不足しており、特にフラキノシンに関しては、環化を担う酵素も明らかになっていませんでした。そこで、東京大学大学院農学生命科学研究科応用生命工学専攻の共同研究グループは、フラキノシンを生産する放線菌、Streptomyces albus G-153/pWFQ株を用いて、この共通のアミノ基除去機構と経路特異的な環化機構の解明に取り組みました。

図1.放線菌の生産するメロテルペノイドの構造とその生合成経路(参考文献1–6).
Nph, ナフテルピン生合成酵素; Fur, フラキノシン生合成酵素; Fnq, フラノナフトキノン生合成酵素; NapB, ナピラジオマイシン生合成酵素
これまでフラキノンシンの生合成においてはMMF(6)が生合成中間体であり、プレニル化酵素Fur7の基質になる、と提唱されていました。6にはすでにアミノ基が存在しないため、5から6への変換の過程でアミノ基の除去が起こると推察されました。そこで、フラキノシン生産株での遺伝子破壊実験と、大腸菌や放線菌で発現させた組換え酵素を用いた試験管内反応によってフラキノンシン生合成の全容を明らかにすることにしました。
今回、これまで提唱されていたような酸化型のキノン型ではなく、図2のような還元型のヒドロキノン型でのフラキノシンの全生合成経路を解明しました。 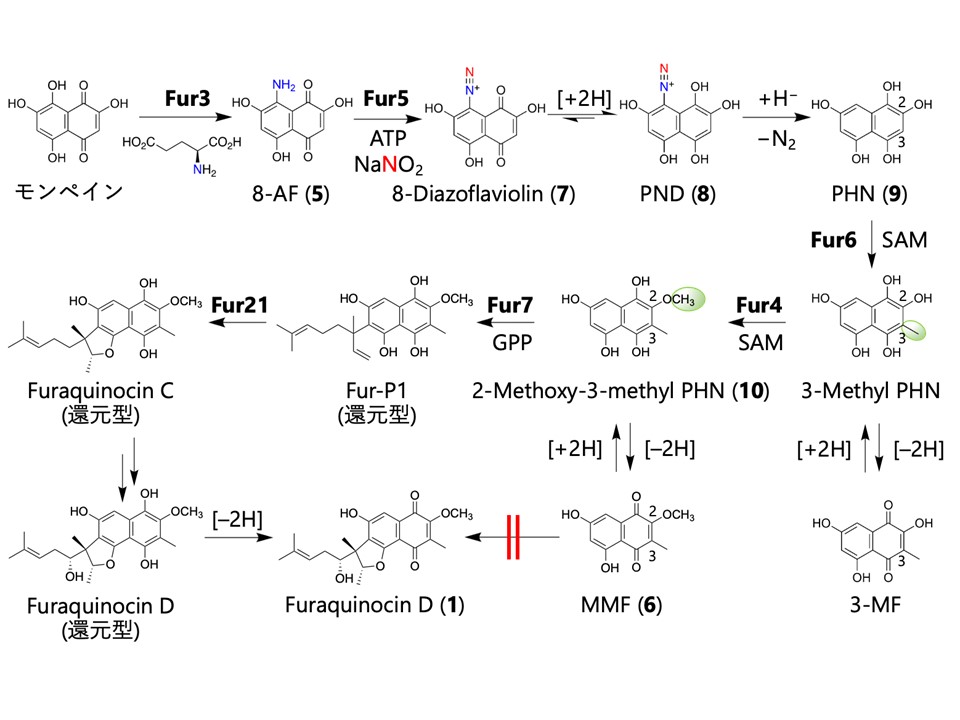
図2.今回提唱したFuraquinocinの還元型での生合成機構.
8-AF, 8-アミノフラビオリン; PND, 2,4,5,7,8-ペンタヒドロキシナフタレン-1-ジアゾニウム; PHN, 1,2,4,5,7-ペンタヒドロキシナフタレン;
3-MF, 3-メチルフラビオリン; MMF, 2-メトキシ-3-メチルフラビオリン
5以降のステップでは、まずジアゾ化酵素 Fur5 による5の8位のアミノ基のジアゾ化が起こりキノン型の8-ジアゾフラビオリン(7)になります。ジアゾ基は、ナフトキノン環の酸化還元電位(注4)を上昇させることでヒドロキノン型の中間体を安定化させるため、7がヒドロキノン型のPND(8)へと変化し、続く窒素ガスの放出によってPHN(9)が生合成されます。このヒドロキノン中間体9はTHNに一つだけヒドロキシ基が増えた構造をしており、分子の対称性が崩れることで、続く二箇所のメチル化の位置が決定づけられることを実験とシミュレーションの両面から明らかにしました。さらにプレニル化酵素Fur7も、従来提唱されていたキノン型の6ではなく、ヒドロキノン型の2-Methoxy-3-methyl PHN(10)を基質に対して反応が促進されたことから、ヒドロキノン型の中間体が生合成後半にも重要であることを示しました。生合成の最終段階で、SAM依存性のメチル基転移酵素に似たFur21がSAM 非依存的に環化反応を触媒することで、フラキノシンがヒドロキノン型として生合成されることを明らかにしました。なおナフテルピンの生合成においても5のジアゾ化は確認され、ヒドロキノン中間体がメロテルペノイドの生合成にとって普遍的に重要であり、何らかの生理的意義を持つ可能性が示唆されました。
本研究では、フラキノシンの生合成機構を詳細に解析することで、最終産物に存在しないアミノ基とヒドロキノン型中間体の重要性を明らかにし、従来のキノン型の推定生合成経路をヒドロキノン型での生合成経路へと塗り替えました。今後は、ヒドロキノン型で生合成されたメロテルペノイドの生理的な意義を解明していくことで、自然界における二次代謝産物の機能理解に繋げたいと考えています。
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「生合成リデザイン」(16H06453)、学術変革領域研究 (A)(研究領域提案型)「予知生合成科学」(22H05120、22H05126)、創薬等ライフサイエンス研究支援基盤事業(BINDS)(JP21am0101070、JP23ama121027)の支援を受けて行われました。野口智弘は、特別研究員(DC1)として日本学術振興会の支援(19J22569)を受けました。
4.発表者
野口 智弘(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程:当時)
趙 凡(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程:当時)
森脇 由隆(東京大学大学院農学生命科学研究科応用生命工学専攻 助教:当時)
山本 秀明(東京大学大学院農学生命科学研究科応用生命工学専攻 修士課程:当時)
工藤 慧(東京大学大学院農学生命科学研究科応用生命工学専攻 博士課程:当時)
永田 隆平(東京大学大学院農学生命科学研究科応用生命工学専攻 特別研究員/日本学術振興会特別研究員PD:当時)
富田 武郎(東京大学大学院農学生命科学研究科応用生命工学専攻 助教:当時)
寺田 透(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
清水 謙多郎(東京大学大学院農学生命科学研究科応用生命工学専攻 教授:当時)
西山 真(東京大学アグロバイオテクノロジー研究センター 教授)
葛山 智久(東京大学大学院農学生命科学研究科応用生命工学専攻 教授)
5.発表雑誌
雑誌名:Chemical Science
論文タイトル:Biosynthesis of the tetrahydroxynaphthalene-derived meroterpenoid furaquinocin via reductive deamination and intramolecular hydroalkoxylation of an alkene
著者:Tomohiro Noguchi (野口 智弘)1、Fan Zhao (趙 凡), 1 Yoshitaka Moriwaki (森脇 由隆), 1,2 Hideaki Yamamoto (山本 秀明), 1 Kei Kudo (工藤 慧), 1 Ryuhei Nagata (永田 隆平), 1 Takeo Tomita (富田 武郎), 1,2 Tohru Terada (寺田 透), 1,2 Kentaro Shimizu (清水 謙多郎), 1,2 Makoto Nishiyama (西山 真), 1,2 and Tomohisa Kuzuyama (葛山 智久)1,2,*
1Graduate School of Agricultural and Life Sciences, The University of Tokyo
2Agro-Biotechnology Research Center, The University of Tokyo
DOI番号:10.1039/D4SC08319A
アブストラクトURL:https://pubs.rsc.org/en/content/articlelanding/2025/sc/d4sc08319a
6.問い合わせ先
東京大学大学院農学生命科学研究科応用生命工学専攻 分子育種学研究室
教授 葛山 智久(くずやま ともひさ)
Tel/Fax:03-5841-3080
E-mail:utkuz@g.ecc.u-tokyo.ac.jp
研究室URL:https://webpark2107.sakura.ne.jp/index.html
研究室Twitter:@Kuzuyama_Lab
7.用語解説
(注1)ジアゾ化
一級アミン (R-NH2) に亜硝酸 (HNO2) などを作用させ、対応するジアゾニウム化合物 (R-N+≡N) を得る反応
(注2)メロテルペノイド
メロテルペノイドはテルペノイド由来の骨格と他の骨格が結合した天然化合物の総称で、多彩な骨格と強い生物活性を示し、放線菌、糸状菌、植物などが主に生産します。医薬品のリード化合物としても注目されています。
(注3)S-アデノシルメチオニン(SAM)
S‑アデノシルメチオニン(SAM)は、メチオニンとATPからメチオニンアデノシルトランスフェラーゼ(MAT)が生成する高エネルギースルホニウム化合物で、多くの SAM 依存性メチル基転移酵素の反応においてメチル基供与体として機能します。
(注4)酸化還元電位
酸化還元電位(ORP)は、溶液中の酸化体と還元体が可逆平衡にあるときの白金電極と標準水素電極の電位差で測定され、ネルンスト式でpHや温度を換算し、値が高いほど酸化力が、低いほど還元力が強い指標となります。キノンの例では値が高いほど還元体のヒドロキノンが安定、低いほど酸化体のキノンが安定となります。
(参考文献1) Shin-ya, K., et al. Isolation and structural elucidation of an antioxidative agent, naphterpin. J. Antibiot. 1990, 43, 444-447.
(参考文献2) Komiyama, K., et al. Novel antibiotics, furaquinocins A and B. Taxonomy, fermentation, isolation and physico-chemical and biological characteristics. J. Antibiot. 1990, 43, 247-252.
(参考文献3) Ishibashi, M., et al. Novel antibiotics, furaquinocins C, D, E, F, G and H. J. Antibiot. 1991, 44, 390-395.
(参考文献4)S. Isogai, M. Nishiyama and T. Kuzuyama, Bioorg. Med. Chem. Lett., 2012, 22, 5823–5826.
(参考文献5)T. Noguchi, S. Isogai, T. Terada, M. Nishiyama and T. Kuzuyama, J. Am. Chem. Soc., 2022, 144, 5435–5440.
(参考文献6)T. Kumano, T. Tomita, M. Nishiyama and T. Kuzuyama, J. Biol. Chem., 2010, 285, 39663–39671.

