ATP依存型ジアゾ化酵素の構造と触媒メカニズムを解明 ――実験科学×計算科学で反応機構を提唱――
発表のポイント
◆ATPを利用して、アミノ基のジアゾ化反応を触媒するジアゾ化酵素CmaA6の立体構造を解明しました。
◆生化学的実験と計算化学的解析から、CmaA6が逐次反応によってジアゾ化反応を触媒することを明らかにしました。
◆本研究の知見を用いることで、ジアゾ化酵素の基質認識を制御することが可能になると期待されます。
概要
過去数年の研究において、亜硝酸とアミノ基を縮合することでジアゾ基を合成するジアゾ化酵素が複数報告されています。しかし、その詳細な反応機構は未だ解明されていませんでした。東京大学大学院農学生命科学研究科・応用生命工学専攻の勝山陽平准教授・寺田透教授・大西康夫教授らの研究グループは、亜硝酸を用いて3-アミノクマル酸 (3-ACA) のジアゾ化を触媒するATP依存型ジアゾ化酵素CmaA6の触媒機構の解明に取り組みました。まず、X線結晶構造解析とクライオ電子顕微鏡単粒子解析によって、CmaA6の基質非結合状態とAMP結合状態の立体構造を解明しました。一方、反応速度論解析から、CmaA6は3つの基質(亜硝酸、ATP、3-ACA)が同時に反応ポケットに結合する逐次反応機構でジアゾ化を触媒することが示唆されました。また、計算科学的解析により、亜硝酸と3-ACAの結合部位および3-ACAが反応ポケットに入るためのトンネルが予想され、部位特異的変異導入実験によってその妥当性が確認されました。
発表内容
微生物は構造や生物活性の多様性に富む様々な種類の天然物を生産します。このような天然物に見られる特徴的な官能基の合成に関与する生合成酵素の発見や触媒機構の解明に向けた研究が、これまで盛んに行われてきました。その中でも、ジアゾ基 (注1) 等の窒素-窒素 (N-N) 結合を形成する酵素の探索や機能解析は近年大きな関心を集めています。
東京大学大学院農学生命科学研究科・応用生命工学専攻の勝山陽平准教授・大西康夫教授らの研究グループは、これまでクレメオマイシン、アラゾペプチン、アベナルミ酸といった放線菌(注2) が生産する複数の天然物の生合成研究を実施しました。その過程で、亜硝酸をアミノ基に縮合させることでジアゾ基を合成する生合成システムが放線菌において普遍的に存在することを明らかにしました。さらに、この反応を触媒する酵素も複数発見しました。しかし、亜硝酸を用いたジアゾ化酵素の詳細な触媒機構は謎のままでした。
そこで、同研究グループは以前に発見した3-アミノクマル酸 (3-ACA) のジアゾ化を触媒するATP依存型ジアゾ化酵素CmaA6に着目しました。CmaA6は、ATPを用いて活性化させた亜硝酸を3-ACAのアミノ基に縮合させることでジアゾ化し、3-ジアゾクマル酸 (3-DCA) を合成する反応を触媒することがわかっていますが (図1 A)、3つの基質 (3-ACA、亜硝酸、ATP) の認識機構や詳細な触媒機構は未知でした。本研究では、CmaA6の立体構造を基に、実験科学と計算科学を組み合わせることで、ジアゾ化酵素の触媒メカニズムの解明を目指しました。
まず、同研究グループはCmaA6の立体構造解析に取り組みました。X線結晶構造解析 (注3) から、基質非結合型の構造 (図1 B) とAMP結合型の構造 (図1 C) を取得しました。また、クライオ電子顕微鏡単粒子解析法 (注4) によっても基質非結合型の構造を取得しました (図1 D)。
次に、CmaA6の3つの基質に対する包括的な反応速度論解析を行いました。その結果、CmaA6が属するANLスーパーファミリーの他の酵素とは異なり、CmaA6は3つの基質が酵素ポケット内に結合した後に反応が進行する「逐次反応」という触媒機構を有していることが明らかになりました (図2)。そのため、CmaA6はANLスーパーファミリーの他の酵素と異なる基質結合様式を有していると予想しました。
次に、CmaA6の立体構造を精査することで、亜硝酸の認識を担うと考えられる3残基 (ヒスチジン, フェニルアラニン, リジン) を見出しました (図3 A)。さらに、3-ACAの結合サイトをドッキングシミュレーションとMDシミュレーションにより検証しました。その結果、CmaA6ではANLスーパーファミリーの他の酵素と異なる位置のポケットに3-ACAを収容することが示唆されました。また、3-ACAの認識を担うと考えられる3残基 (グルタミン、アルギニン、アスパラギン) も見出されました (図3 B)。これらのアミノ酸残基を他のアミノ酸残基に置換したCmaA6の組換えタンパク質をそれぞれ調製し、酵素活性を調べたところ、上述の基質認識機構が正しいことが示唆されました。さらに、計算科学的手法により、3-ACAが基質ポケットに侵入するための新たなトンネルも見出しました。これらは、ANLスーパーファミリーに属する酵素の反応機構の常識とは異なる結果であり、ジアゾ化酵素特有のものであると考えられます。
以上のように、X線結晶構造解析とクライオ電子顕微鏡単粒子解析という2つの手法によって、ジアゾ化酵素 (CmaA6) の立体構造を世界に先駆けて解明しました。さらに、反応速度論解析や変異酵素の活性解析といった実験科学と各種計算科学的な手法を組み合わせることで、CmaA6の触媒機構の一端を明らかにしました。本研究は、ジアゾ基を始めとするN-N結合を有する天然物の生合成機構と酵素学に関する極めて重要な知見を与えるものであり、今後、ジアゾ基を種々の化合物に酵素的に導入する技術的基盤になると考えられます。
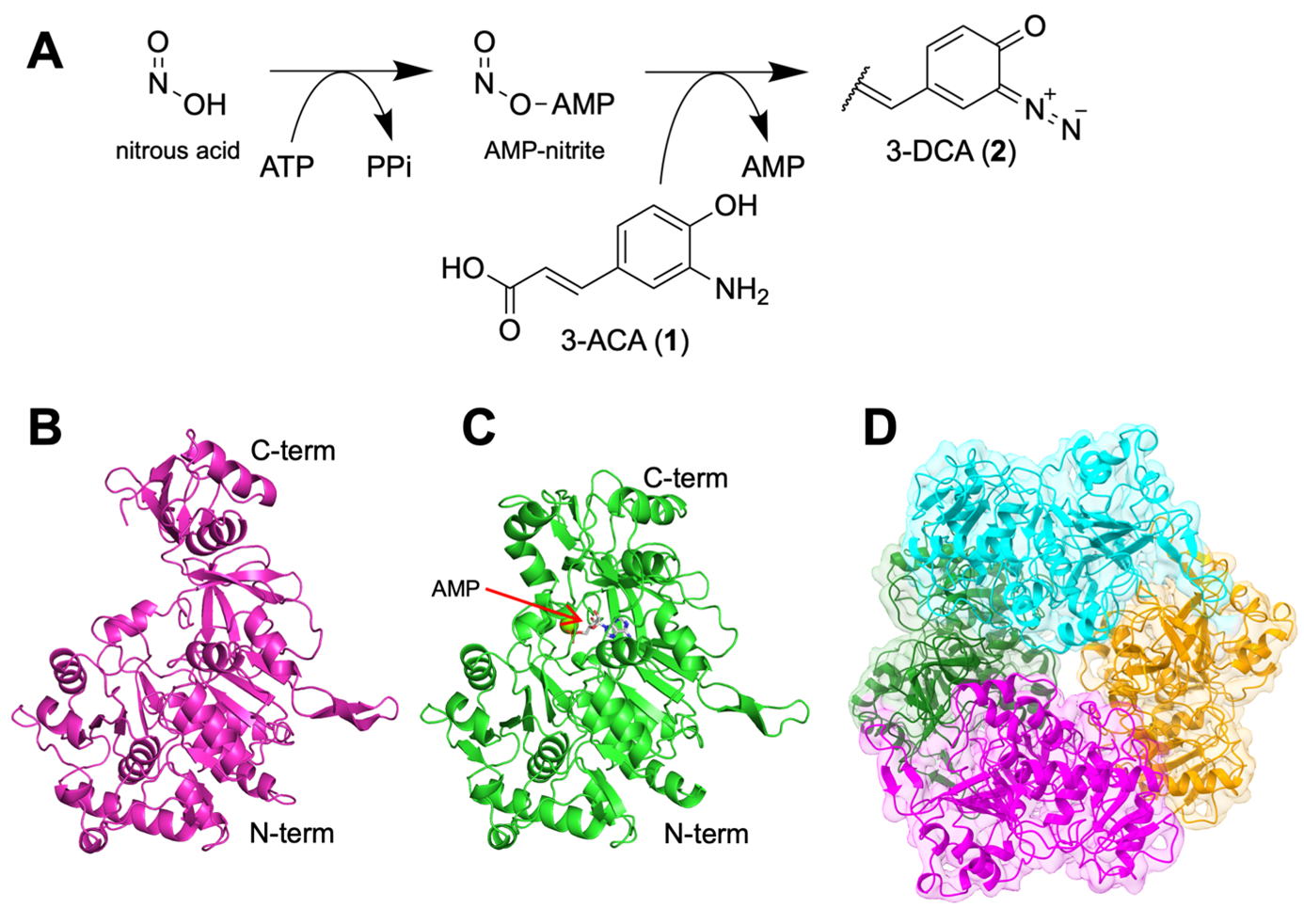
図1:CmaA6が触媒する反応 (A) と、本研究で得られたCmaA6の立体構造 (B – D)。
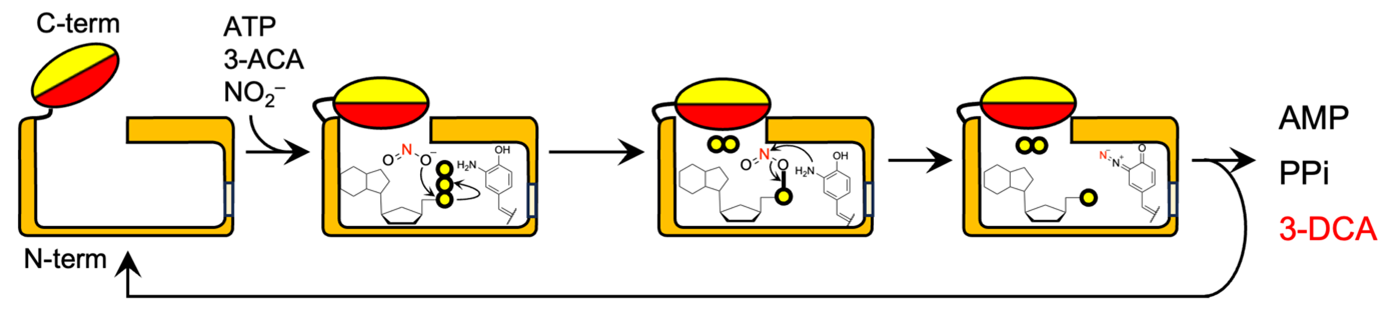
図2:CmaA6が触媒する反応の模式図。3つの基質が酵素ポケットに結合してから反応が進行し、3つの生成物が放出される。
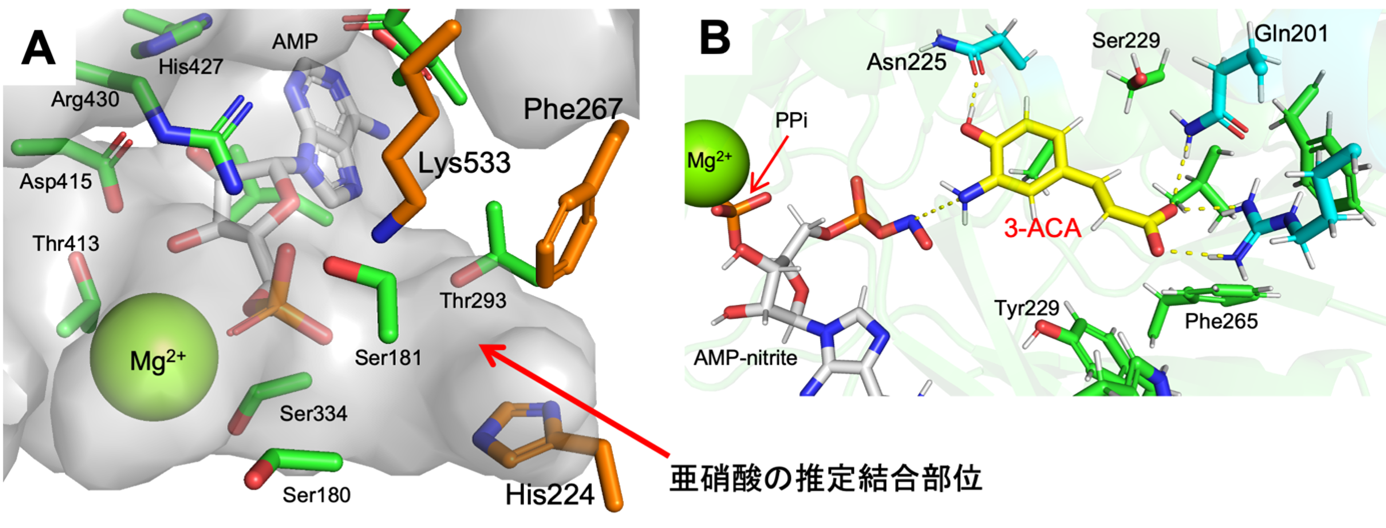
図3:X線結晶構造解析より得られた構造から予想される亜硝酸の結合位置 (A) と、
ドッキングシミュレーションとMDシミュレーションから推定された3-ACAの結合位置 (B)。
参考文献
- Sugai et al. Nat. Chem. Biol., 12(2), 73-75.
- Kawai et al. Angew. Chem. Int. Ed., 60(18), 10319-10325
- Kawai et al. Angew. Chem. Int. Ed., 61(45), e202211728
発表者・研究者等情報
東京大学大学院農学生命科学科学研究科 応用生命工学専攻
川合 誠司 日本学術振興会特別研究-PD (当時)
唐澤 昌之 特任研究員
寺田 透 教授
勝山 陽平 准教授
大西 康夫 教授
東京科学大学 総合研究院 難治疾患研究所
森脇 由隆 准教授
論文情報
雑誌名: Angewandte Chemie International Edition
題 名: Structural Basis for the Catalytic Mechanism of ATP-Dependent Diazotase CmaA6
著者名: Seiji Kawai, Masayuki Karasawa, Yoshitaka Moriwaki, Tohru Terada, Yohei Katsuyama *, Yasuo Ohnishi
DOI: 10.1002/anie.202505851
URL: https://doi.org/10.1002/anie.202505851
研究助成
本研究は、科研費「19H04645、19H05685、22H05130、22H05126、22KJ1046」、JSPS A3フォーサイト事業、生命科学・創薬研究支援基盤事業 (AMED)、プロアクティブ環境学国際卓越大学院の支援により実施されました。
用語解説
(注1)ジアゾ基
窒素原子2つからなる官能基(=N+=N-)です。反応性が高く、さまざまな反応の足場として有機化学合成に用いられることで有名です。
(注2) 放線菌
主に土壌中に生息する、グラム陽性細菌の一群のことを指します。原核生物としては高度な形態分化を示すほか、ゲノムDNAのGC含量が高いという特徴を示します。また、抗生物質や抗がん剤として用いられている多くの天然物の生産を担うことで知られています。
(注3) X線結晶構造解析
タンパク質の結晶にX線を照射し、その回折像から得られる電子密度を基にタンパク質の立体構造を明らかにする手法です。
(注4) クライオ電子顕微鏡単粒子解析法
タンパク質の試料を極低温で凍結させ、電子顕微鏡で多数のタンパク質粒子を撮影し、画像処理によってタンパク質の立体構造を明らかにする手法です。2017年ノーベル化学賞を受賞した技術です。
問合せ先
(研究内容については発表者にお問合せください)
東京大学大学院農学生命科学研究科 応用生命工学専攻 醗酵学研究室
准教授 勝山 陽平(かつやま ようへい)
Tel:03-5841-5124 E-mail:aykatsuhko[at]g.ecc.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。

