タンパク質の新たな分解システム ―ファイロジェンによる葉化誘導メカニズム解明で発見!
- 発表者
- 北沢 優悟 (東京大学大学院農学生命科学研究科 生産・環境生物学専攻 特任研究員)
岩渕 望 (東京大学大学院農学生命科学研究科 生産・環境生物学専攻 特任研究員)
松本 旺樹 (東京大学大学院農学生命科学研究科 生産・環境生物学専攻 修士課程2年)
前島 健作 (東京大学大学院農学生命科学研究科 生産・環境生物学専攻 准教授)
発表のポイント
- ファイトプラズマ (注1) の葉化誘導因子ファイロジェン (注2) が、植物に花を咲かせる因子 (MADS転写因子) (注3) をこれまでにないしくみで分解することを発見しました。
- ファイロジェンは、MADS転写因子と輸送タンパク質と三者複合体を形成することで、MADS転写因子をタンパク質分解装置に輸送し分解していました。
- この仕組みを利用すれば、生体内の標的タンパク質を自由に分解する創薬技術の開発につながります。
発表概要
植物病原細菌ファイトプラズマは、植物の花を葉に変化させる不思議な病気「葉化病」を引き起こします (図1)。この症状は、ファイトプラズマが分泌する葉化誘導因子ファイロジェンが、植物の花形成因子であるMADS転写因子タンパク質分解装置であるプロテアソームへと輸送・分解し、正常な花器官形成を阻害することで誘導されます。一般にプロテアソーム輸送には、標的タンパク質がユビキチンと結合 (ユビキチン化) することが必須ですが (図2)、ファイロジェンが特定のMADS転写因子をプロテアソームへと輸送するメカニズムは不明でした。
今回、東京大学大学院農学生命科学研究科植物病理学研究室の北沢優悟特任研究員と前島健作准教授ら の研究グループは、ファイロジェンが標的MADS転写因子に結合したのち、プロテアソーム輸送タンパク質にも結合して三者複合体を形成することで、ユビキチン化を介さずに標的MADS転写因子をプロテアソームへと直接輸送していることを明らかにしました (図2)。ユビキチン非依存的な標的タンパク質のプロテアソーム輸送は、動物病原細菌を含め他の細菌では報告例のないユニークな病原性メカニズムです。
プロテアソームはヒトを含む真核生物に広く保存されているため、今後、ファイロジェンの機能を調節することで、幅広い分野において、特定のタンパク質を選択的に分解する実験技術や創薬技術の開発につながると期待されます。
発表内容

図1 ファイトプラズマに感染し「葉化病」を発症したアジサイ (右)
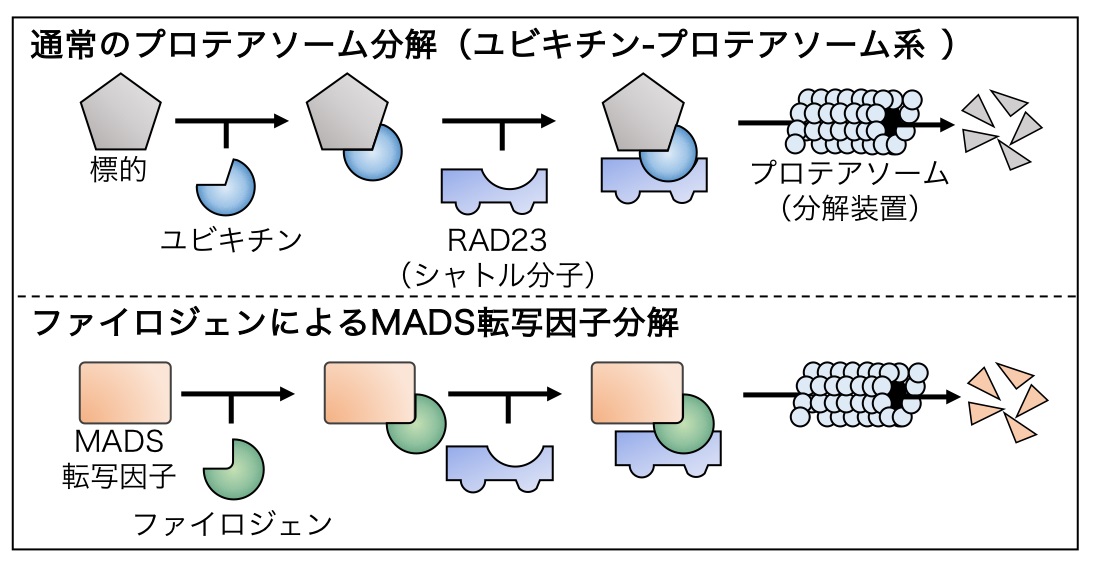
図2 ファイロジェンによるMADS転写因子分解モデル
一般的なプロテアソームによるタンパク質分解では、標的タンパク質にユビキチンが結合、これを目印としてシャトル分子がさらに結合することで、標的がプロテアソームへと輸送され、分解される (上段)。一方でファイロジェンはMADS転写因子とシャトル分子RAD23に同時に結合し、ユビキチンの代わりに両者の相互作用を仲介する (下段)。これにより、MADS転写因子はユビキチン非依存的にプロテアソームへと輸送され、分解される。
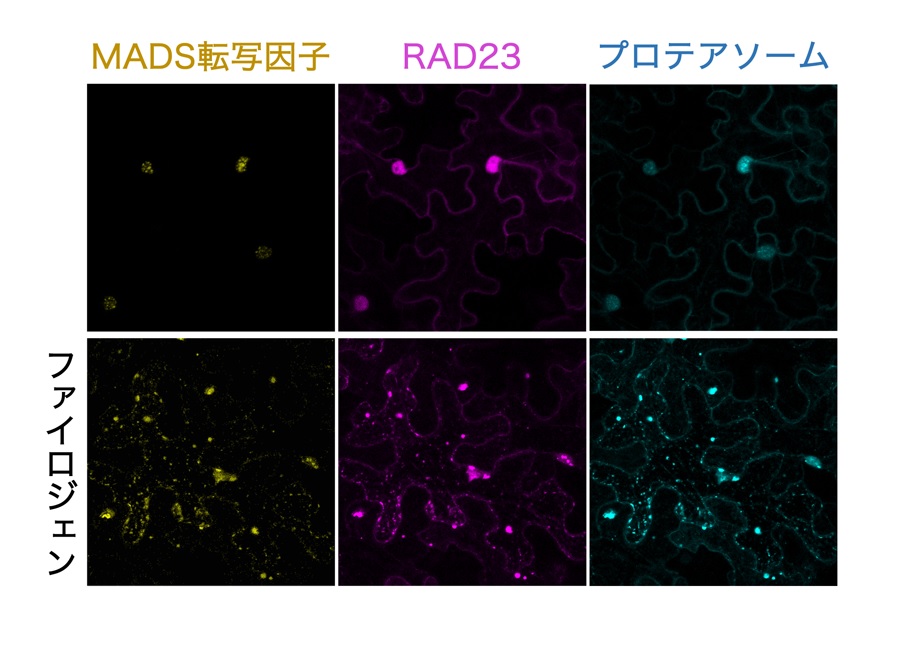
図3 ファイロジェンを介したMADS転写因子のRAD23、およびプロテアソームとの相互作用
MADS転写因子、RAD23、プロテアソームをそれぞれ黄色、赤紫色、水色の蛍光タンパク質と連結し、植物細胞内で発光させた。本来これらのタンパク質は主に細胞の核 (上段、大きな丸い蛍光) に集中して存在するが、ファイロジェンが存在する時には細胞全体で小さな点状に集合し、相互作用している様子が観察された。
(研究の背景)
ファイトプラズマは、1967年に東京大学農学部の植物病理学研究室において発見された、植物の篩部に寄生しヨコバイなどの昆虫により媒介される植物病原細菌であり、葉化病など様々な病害を植物に引き起こします。同研究室はさまざまなファイトプラズマ病発生メカニズムを明らかにしており、その一つが葉化誘導因子「ファイロジェン」の特定と機能の解析です。ファイロジェンはファイトプラズマが共通してもつ分泌タンパク質であり、花の形成に関わる特定の花形成因子 (MADS転写因子) に結合、植物が持つタンパク質分解装置プロテアソームを利用して分解することで花の形成過程を阻害し、葉化を誘導することが明らかになっていました。
プロテアソームによるタンパク質の分解は選択的であり、一般にユビキチン-プロテアソーム系と呼ばれる経路に制御されています (図2)。本経路ではまず、標的に「目印」となるユビキチンという小さなタンパク質が結合します (ユビキチン化)。ユビキチン化したタンパク質はプロテアソームと直接結合、あるいはプロテアソームとユビキチン化タンパク質の両方を認識するシャトル分子によってプロテアソームへと運ばれ、分解されます。ファイロジェンによるMADS転写因子の分解においてもユビキチンの関与が疑われていましたが、一方でシャトル分子の一種RAD23がファイロジェンと結合することも知られており、ファイロジェンによる標的分解の分子メカニズムは詳しくわかっていませんでした。
(研究内容)
本研究では、ファイロジェン、MADS転写因子、RAD23の三者間相互作用を解析するとともに、MADS転写因子分解におけるユビキチンの重要性を解析しました。蛍光標識した各タンパク質の局在解析、および共免疫沈降法を用いて植物細胞内でのタンパク質間相互作用を解析した結果、MADS転写因子とRAD23がファイロジェンを介して相互作用し、三者からなる複合体が形成されること、この複合体がプロテアソームとも相互作用していることがわかりました (図3)。また、この複合体に含まれるファイロジェンがユビキチン化されることが確認されましたが、このユビキチン化はMADS転写因子の分解に必須でありませんでした。加えて、ファイロジェン、MADS転写因子、RAD23をそれぞれ精製し、他の植物タンパク質が存在しない環境で相互作用解析を行った場合にも、三者間相互作用が確認されました。以上より、ファイロジェンはユビキチンの代わりに標的MADS転写因子とRAD23との相互作用を直接仲介することで、標的因子のユビキチン非依存的なプロテアソーム分解を誘導すると考えられました。
(社会的意義)
植物病原細菌に限らず多くの病原細菌の病原性因子が宿主のプロテアソームを利用して標的を分解しますが、そのメカニズムは不明なものが多く、これまで分かったものの大半がユビキチンを利用したものでした。今回判明したファイロジェンによるユビキチン非依存的なプロテアソーム分解誘導メカニズムは、これまで未知の新たなしくみです。
また、通常のユビキチン-プロテアソーム系では標的のユビキチン化のために複数の酵素が必要となりますが、ファイロジェンによる標的分解はそれらを必要とせず、シャトル分子、及び標的との結合のみで行われます。したがって、標的タンパク質に結合する抗体などをファイロジェンに付けておけば、どんな細胞内タンパク質でも分解できるシステムの構築が可能と考えられます。プロテアソームによる選択的タンパク質分解系は医薬品開発などでも着目されている分野であり、ファイロジェンを利用すれば、新たな応用技術開発につながることが期待されます。
本研究は、日本学術振興会科学研究費補助金 (課題番号:25221201、19K15840、20H02991、20K22562、21H04722、21K14847、21K14853) の支援を受けて行われました。
発表雑誌
- 雑誌名
- 「The Plant Cell」(オンライン版:3月2日)
- 論文タイトル
- A phytoplasma effector acts as a ubiquitin-like mediator between floral MADS-box protein and proteasome shuttle protein
- 著者
- Yugo Kitazawa · Nozomu Iwabuchi · Kensaku Maejima · Momoka Sasano · Oki Matsumoto · Hiroaki Koinuma · Ryosuke Tokuda · Masato Suzuki · Kenro Oshima · Shigetou Namba · Yasuyuki Yamaji
- DOI番号
- 10.1093/plcell/koac062
- 論文URL
- https://doi.org/10.1093/plcell/koac062
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻 植物病理学研究室
准教授 前島 健作 (まえじま けんさく)
Tel:03-5841-1613
Fax:03-5841-5090
E-mail:amaejima<アット>mail.ecc.u-tokyo.ac.jp <アット>を@に変えてください。
研究室URL:http://park.itc.u-tokyo.ac.jp/ae-b/planpath/
用語解説
- 注1 ファイトプラズマ
1967年にマイコプラズマ様微生物 (mycoplasma-like organism, MLO) として東京大学植物病理学研究室で発見され、2004年に全ゲノムが解読された、ファイトプラズマ属 (モリキューテス綱) に分類される植物病原細菌。1,000種以上の植物に感染し、世界中の農業生産に被害をもたらしている重要な植物病原細菌である。植物の篩部に寄生し、ヨコバイ等の昆虫により植物から植物へと媒介される。植物に萎縮病、天狗巣病、葉化病 (花の葉化・緑化・突き抜け) などの特徴的な病気を引き起こし、植物を枯らしてしまうことも多い。ファイトプラズマ病は身近にも頻繁に認められる。葉化病によって緑色の花が咲くアジサイは、以前は商品価値が認められ品種として流通していた一方、現在は各地で病気として問題となっている。また、クリスマスシーズンの風物詩である鉢植えのポインセチアは、全て背丈を小さくするためにファイトプラズマに人工的に感染させられ、天狗巣病を発病したものである (健全なポインセチアは2mにもなる)。
<ファイトプラズマが引き起こす主な症状>
萎縮: 茎や葉の生長が害され、著しく矮化する症状
天狗巣: 側芽が異常に発生し、小さな枝葉が密生する症状
花の葉化: 花びらやがく・雌しべ・雄しべが葉に置き換わってしまうこと - 注2 葉化誘導因子 ファイロジェン
phyllo- (葉) + -gen (を生ずるもの=gene[遺伝子])。葉化病 (phyllody: phyllo-[葉] + -ody[になる変化]) の原因である遺伝子ファミリーphyllody-inducing gene family (葉化誘導遺伝子ファミリー) の略。ファイロジェンは植物に普遍的な花形成因子 (MADS転写因子) を標的とすることで、あらゆる植物に葉化病を引き起こすことができると考えられている。(以下、関連のプレスリリース)
・植物病原体が花を葉に変えるメカニズムを解明 【2011年9月12日】
・「花」を「葉」に変える病気の謎を解く ―原因遺伝子の発見と発症メカニズムの解明― 【2014年3月18日】
・1つの病原性因子があらゆる植物種の花形成因子を分解する ―葉化病発症メカニズムは植物に共通であることを解明― 【2017年5月16日】
・葉化病発症の仕組みを構造化学的に解明 ―葉化病治療薬開発や新品種開発に新たな道― 【2019年4月19日】
・葉化病の病原タンパク質「ファイロジェン」の機能は1アミノ酸の変異で制御される ―水平移動による進化と病原性の変異メカニズムを解明― 【2020年8月19日】 - 注3 MADS転写因子
植物の発達を制御する重要な転写因子であり、花の形成を制御するものはA・B・C・Eクラスの4つに分類される (ABCEモデル)。各クラスのMADS転写因子が様々な組み合わせで複合体 (四量体) を形成して機能し、どの植物細胞がどの花器官になるかは、4分子の組み合わせによって決まる。例えばAが1分子、Bが2分子、Eが1分子組み合わさった場合は花びらが形成される。これらの因子が失われると花は葉に退化する。
ファイロジェンは特にA・EクラスのMADS転写因子を標的とし、これらに結合、分解を誘導する。特にEクラスMADS転写因子は全花器官の形成に必要なため、ファイロジェンによってすべての花器官の発達が妨げられ、葉に退化してしまう。

